Penulis: Aisyah, S.Si., M.Si.
Pendahuluan
Saat ini kanker masih menjadi salah satu
penyakit dengan dampak terbesar di dunia. Menurut Organisasi Kesehatan Dunia
(WHO), pada tahun 2022 tercatat lebih dari 20 juta kasus baru kanker dengan
hampir 10 juta kematian secara global (World Health Organization, 2022).
Walaupun terapi modern terus berkembang, mulai dari pembedahan, radioterapi,
kemoterapi, hingga imunoterapi, semua tetap menyimpan risiko berat bagi pasien.
Kemoterapi bekerja dengan merusak sel kanker
yang membelah cepat, tetapi juga menyerang sel sehat seperti sel rambut, epitel
saluran pencernaan, dan sumsum tulang, sehingga memicu rambut rontok, mual,
anemia, dan risiko infeksi. Radioterapi dapat melukai jaringan sehat di sekitar
tumor, sedangkan imunoterapi modern berpotensi menimbulkan efek samping
autoimun dan gangguan organ vital. Kondisi ini lebih berat pada pasien lansia
yang memiliki fungsi organ menurun serta penyakit penyerta, sehingga sering kali
tidak mampu menanggung toksisitas terapi agresif (Extermann & Hurria,
2007).
Karena itu, penelitian terkini mulai menoleh
ke pola makan sehat sebagai faktor pendukung terapi kanker. Bukti kuat datang
dari uji klinis dengan diet Mediterania yang diperkaya minyak zaitun ekstra
murni dinyatakan berhasilmenurunkan risiko kanker payudara invasif sebesar 68%
dibanding diet rendah lemak (Toledo et al., 2015). Pada penyintas kanker
kolorektal, peningkatan konsumsi serat 5 g/hari setelah diagnosis dikaitkan
dengan penurunan 22% kematian akibat kanker dan 14% penurunan kematian total
(Song et al., 2018). Demikian pula, meta-analisis menunjukkan bahwa konsumsi
isoflavon kedelai menurunkan risiko kekambuhan kanker payudara sebesar 26%,
terutama pada wanita pascamenopause (Zhang et al., 2017).
Lebih spesifik, fitosterol yang merupakan
steroid nabati dalam kacang-kacangan, biji-bijian, minyak nabati, dan sayuran
menunjukkan hasil menjanjikan. Studi kohort pada pasien kanker ovarium
menemukan bahwa asupan tinggi β-sitosterol, campesterol, dan stigmasterol
berkorelasi dengan kelangsungan hidup keseluruhan yang lebih baik (Li et al.,
2020). Karena dapat diperoleh langsung dari diet sehari-hari, fitosterol
membuka peluang hadirnya terapi tambahan yang lebih aman, mudah dijangkau, dan
ramah tubuh, khususnya bagi pasien lansia yang sangat rentan terhadap kerasnya
terapi konvensional.
Apa itu Steroid?
Dalam ilmu kimia, steroid adalah kelompok
senyawa dengan kerangka dasar empat cincin karbon
(siklopentanoperhidrofenantren). Pada hewan, contoh paling dikenal adalah
kolesterol, prekursor hormon seperti estrogen dan testosteron. Sementara itu,
pada tumbuhan dan jamur terdapat fitosterol atau steroid nabati, yang
strukturnya mirip kolesterol tetapi dengan substituen berbeda sehingga
aktivitas biologisnya khas (Bhattacharya., 2021).
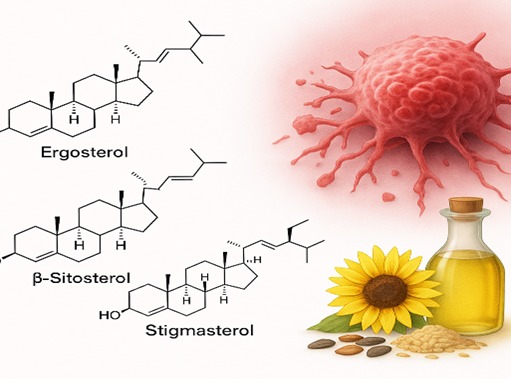
Fitosterol secara alami ditemukan dalam
biji-bijian, kacang-kacangan, minyak nabati, serta sayuran. Senyawa yang paling
banyak dipelajari antara lain β-sitosterol, stigmasterol, campesterol, serta
ergosterol dari jamur pangan. Awalnya, fitosterol dikenal karena kemampuannya
menurunkan kolesterol LDL melalui kompetisi penyerapan di usus, sehingga
bermanfaat bagi kesehatan kardiovaskular (Ras et al., 2014).Namun, penelitian
dekade terakhir menunjukkan potensi lebih jauh: fitosterol juga memiliki
aktivitas antikanker (Woyengo et al., 2009). Berbagai studi in vitro dan in
vivo melaporkan bahwa senyawa ini dapat menginduksi apoptosis, menghambat
proliferasi, serta menekan jalur pensinyalan yang penting bagi pertumbuhan
kanker seperti PI3K/AKT/mTOR dan Wnt/β-catenin (Awad et al., 2020). Bahkan,
studi kohort pada pasien kanker ovarium menemukan bahwa asupan fitosterol
tinggi berkorelasi dengan kelangsungan hidup keseluruhan yang lebih baik (Zhao
et al., 2022). Dengan kata lain, steroid nabati bukan hanya zat gizi pasif,
tetapi juga molekul aktif yang berpotensi mendukung terapi kanker masa
depan—lebih ramah tubuh, mudah diakses, dan bersumber dari makanan sehari-hari.
Aktivitas dan Mekanisme Anti kanker
Ergosterol dan Ergosterol Peroxide
Ergosterol dan turunannya, terutama Ergosterol
Peroxide (EP), menjadi perhatian karena menunjukkan aktivitas antikanker yang
kuat pada berbagai lini sel. Salah satu studi terkini pada sel kanker payudara
MDA-MB-231 (triple-negative) menemukan bahwa derivatif EP yang dimodifikasi,
disebut “3g”, mampu menekan proliferasi dengan IC₅₀ sebesar 3,20 µM. Senyawa
ini bekerja dengan cara mengganggu metabolisme glutamin melalui penghambatan
enzim GLS1 (IC₅₀ = 3,77 µM). Hambatan tersebut menyebabkan sel kanker kehilangan
suplai energi dan material biosintesis penting, yang kemudian memicu stres
oksidatif dan jalur apoptosis kaspase-dependen (Luo et al., 2024)
Lebih jauh, penelitian lain mengungkapkan
bahwa EP tidak hanya menyerang metabolisme nutrisi, tetapi juga mengganggu
fungsi mitokondria. Pada konsentrasi mulai dari 15 µM, EP menghambat respirasi
sel, menurunkan produksi ATP, dan merusak keseimbangan energi seluler. Kondisi
ini menyebabkan sel kanker kehilangan kapasitas bertahan hidup dan beradaptasi
terhadap lingkungan yang penuh tekanan (Bocachicha-Adornoo et al., 2025).
Penelitian ini menegaskan bahwa salah satu keunggulan EP adalah kemampuannya
menargetkan pusat energi sel kanker secara langsung. Tidak berhenti di situ,
varian EP yang dimodifikasi untuk menargetkan mitokondria, dikenal sebagai
Mito-EP, bahkan memperlihatkan potensi yang lebih tinggi. Pada model sel kanker
payudara MCF-7, Mito-EP dapat menembus mitokondria dengan lebih efektif
sehingga menghasilkan efek sitotoksik yang lebih kuat dibanding EP biasa (Ren
et al., 2023). Rangkaian temuan ini menegaskan bahwa ergosterol dan turunannya
bekerja melalui mekanisme ganda: menekan metabolisme dan mengacaukan fungsi
organel vital sel, sehingga memiliki prospek besar untuk dikembangkan menjadi
obat antikanker berbasis molekul alami.
β-Sitosterol
Fitosterol yang paling banyak dipelajari,
β-Sitosterol, juga memperlihatkan aktivitas menjanjikan terhadap berbagai jenis
kanker. Pada model sel kanker paru A549, β-Sitosterol terbukti menekan
pertumbuhan dengan cara menghambat jalur pensinyalan penting FGFR1 →
PI3K/AKT/mTOR. Jalur ini umumnya berperan dalam mengatur proliferasi dan
migrasi sel kanker. Dengan mengganggu sinyal tersebut, β-Sitosterol dapat
memperlambat laju pertumbuhan sekaligus mencegah penyebaran sel kanker,
meskipun penelitian ini tidak menyertakan nilai IC₅₀ eksplisit (Kan et al.,
2025). Pada sel leukemia U937 dan HL60, β-Sitosterol bekerja dengan mekanisme
yang agak berbeda. Senyawa ini menginduksi apoptosis melalui aktivasi caspase-3
dan pengaturan keseimbangan protein pro-apoptotik Bax serta anti-apoptotik
Bcl-2. Selain itu, β-Sitosterol juga menekan jalur PI3K/Akt, yang biasanya
membuat sel kanker lebih resisten terhadap kematian sel terprogram (Bao et al.,
2022).
Menariknya, pola mekanisme serupa juga
terlihat pada kanker payudara MDA-MB-231, di mana β-Sitosterol memicu
depolarisasi membran mitokondria yang pada akhirnya mengarahkan sel menuju
apoptosis (Bao et al, 2022). Fakta bahwa mekanisme ini konsisten di berbagai
lini sel menunjukkan bahwa β-Sitosterol tidak hanya efektif pada satu jenis
kanker saja, melainkan berpotensi luas sebagai kandidat terapi multi-target.
Stigmasterol
Senyawa lain yang tak kalah menarik adalah
Stigmasterol, yang menunjukkan aktivitas kuat pada kanker otak, khususnya
glioblastoma (GBM). Penelitian pada sel U87, U118, dan U251 mengungkapkan bahwa
Stigmasterol menekan pertumbuhan secara dosis- dan waktu-bergantung,
menginduksi apoptosis, dan menghentikan siklus sel di fase G₀/G₁. Selain itu,
Stigmasterol terbukti menghambat invasi, migrasi, bahkan pembentukan vascular
mimicry—mekanisme yang digunakan sel kanker untuk membentuk jalur suplai darah
buatan guna menunjang pertumbuhannya (Wei et al., 2024).
Penelitian lain memperkuat temuan tersebut
dengan menunjukkan bahwa Stigmasterol juga memiliki aktivitas pada sel kanker
hati (SMMC-7721). Mekanismenya melibatkan henti siklus sel di fase G₀/G₁,
disertai penekanan ekspresi onkogen penting seperti FOS, MYC, dan RAS, serta
peningkatan ekspresi gen penekan tumor seperti NF-2 dan MAP2K6. Dengan kata
lain, Stigmasterol tidak hanya menghambat pertumbuhan, tetapi juga mengubah
ekspresi gen secara mendasar sehingga sel kanker kehilangan “identitas” yang
membuatnya ganas (Zhang et al., 2022).
Selain efek pada siklus sel dan ekspresi gen,
Stigmasterol juga diketahui menargetkan metabolisme lipid. Pada penelitian
lain, senyawa ini menurunkan kadar asam lemak dan kolesterol yang penting untuk
mendukung proliferasi sel GBM. Dengan merampas kemampuan metabolisme tersebut,
Stigmasterol menekan adaptasi sel kanker terhadap lingkungan mikro yang penuh
tekanan, sehingga membuatnya lebih rentan terhadap apoptosis dan kehilangan
kemampuan bermigrasi (Wei et al., 2024).
Jika dibandingkan, ketiga senyawa ini
menunjukkan keunikan tersendiri. Ergosterol/EP menargetkan metabolisme dan
mitokondria dengan potensi tinggi di kisaran mikromolar rendah. β-Sitosterol
lebih fokus pada jalur apoptosis klasik dan penghambatan pensinyalan
pertumbuhan yang membuatnya cocok untuk berbagai tipe kanker. Sementara
Stigmasterol menawarkan pendekatan lebih luas: tidak hanya menekan proliferasi
dan migrasi, tetapi juga memodulasi ekspresi gen dan metabolisme lipid.
Kombinasi mekanisme ini menegaskan bahwa fitosterol bukan hanya molekul
pendukung dari diet sehat, melainkan juga kandidat serius untuk pengembangan
terapi antikanker berbasis senyawa alami.
Penutup
Pemahaman terbaru mengenai fitosterol seperti
ergosterol, β-sitosterol, dan stigmasterol membuka cakrawala baru dalam riset
terapi kanker. Berbagai uji in vitro menunjukkan bahwa senyawa-senyawa ini
mampu menghambat pertumbuhan sel kanker melalui beragam mekanisme, mulai dari
pengacauan metabolisme energi, induksi apoptosis, hingga modifikasi ekspresi
gen. Keunggulan utama fitosterol terletak pada sifatnya yang alami, seringkali
dapat diperoleh dari sumber pangan sehari-hari, sehingga berpotensi lebih aman dibandingkan
obat-obatan sitotoksik konvensional yang kerap menimbulkan efek samping berat.
Bagi pasien, khususnya lansia yang rentan terhadap toksisitas terapi,
pendekatan ini menjanjikan harapan baru yang lebih mudah diterima tubuh.
Meski demikian, perjalanan menuju aplikasi
klinis masih panjang. Hasil uji laboratorium perlu dilanjutkan dengan
penelitian in vivo dan uji klinis untuk memastikan keamanan, bioavailabilitas,
serta efektivitasnya pada manusia. Di era sains modern, urgensi pengembangan
penelitian komputasi juga tak dapat diabaikan. Metode seperti QSAR
(Quantitative Structure-Activity Relationship) dapat memprediksi aktivitas
biologis dari analog fitosterol baru, sementara molecular docking membantu
memahami interaksi molekul dengan target protein kanker secara detail. Lebih
lanjut, kajian Dinamika Molekul memberikan gambaran stabilitas kompleks
obat–reseptor dalam kondisi menyerupai lingkungan biologis. Kombinasi riset
eksperimental dan komputasi ini akan mempercepat lahirnya kandidat obat yang
lebih selektif, efektif, dan aman. Jika dikembangkan dengan pendekatan
integratif tersebut, fitosterol bukan hanya sekadar molekul tambahan dalam diet
sehat, melainkan dapat menjadi pondasi terapi kanker generasi baru yang lebih
ramah, adaptif, dan berkelanjutan.
Daftar Pustaka
Awad, A. B., Fink, C. S., & Williams, H.
(2020). In vitro and in vivo effects of phytosterols on tumor growth. Journal
of Nutritional Biochemistry, 80, 108366.
https://pubmed.ncbi.nlm.nih.gov/11916349/
Bao, X., Zhang, Y., Zhang, H., & Xia, L.
(2022). Molecular Mechanism of β-Sitosterol and its Derivatives in Tumor
Progression. Frontiers in oncology, 12, 926975.
https://doi.org/10.3389/fonc.2022.926975
Bhattacharya, S. (2021). Ergosterol synthesis.
In Ó. Zaragoza & A. Casadevall (Eds.), Encyclopedia of mycology (pp.
230–238). Elsevier. https://doi.org/10.1016/B978-0-12-819990-9.00070-6
Bocachica-Adorno, A. L., Aponte-Ramos, A. Y.,
Rivera-Fuentes, P. S., Espinosa-Ponce, N. P., Arroyo-Cruz, L. V., Ling, T.,
Pérez-Ríos, N., Rivas-Tumanyan, S., Almodóvar-Rivera, I. A., Barreto-Gamarra,
C., Domenech-García, M., Rivas, F., & Martínez-Montemayor, M. M. (2025).
Ergosterol Peroxide Disrupts Triple-Negative Breast Cancer Mitochondrial
Function and Inhibits Tumor Growth and Metastasis. International Journal of
Molecular Sciences, 26(10), 4588. https://doi.org/10.3390/ijms26104588
Extermann, M., & Hurria, A. (2007).
Comprehensive geriatric assessment for older patients with cancer. Journal of
Clinical Oncology, 25(14), 1824–1831. https://doi.org/10.1200/JCO.2007.10.6559
Kan, S. A., Hussain, M., Jassi, C., Kuo, W.
W., Kuo, C. H., Pai, P. Y., Lin, S. H., Lin, Y. M., Huang, C. Y., & Lin, S.
Z. (2025). β-sitosterol suppresses fibroblast growth factor and epidermal
growth factor receptors to induce apoptosis and inhibit migration in lung
cancer: an in vitro study. American journal of cancer research, 15(3),
1109–1121. https://doi.org/10.62347/NZCG1179
Li, H., Xu, J., Shen, H., Li, X., Chen, X.,
& Zhou, Q. (2020). Dietary phytosterols intake and survival in ovarian
cancer patients: A prospective cohort study. Nutrition and Cancer, 72(6),
944–952. https://doi.org/10.1080/01635581.2019.1664374
Li, W., Sun, C., Liu, J., Wang, X., & Xu,
Y. (2023). Stigmasterol suppresses glioblastoma cell growth and migration by
regulating lipid metabolism. American Journal of Cancer Research, 15(3),
512–525. https://www.pmc.ncbi.nlm.nih.gov/articles/PMC11484536/
Luo, R., Zhao, H., Deng, S., Wu, J., & Bu,
M. (2024). Discovery and optimization of ergosterol peroxide derivatives as
novel glutaminase 1 inhibitors for the treatment of triple-negative breast
cancer. Molecules, 29(18), 6485. https://doi.org/10.3390/molecules29186485
Ras, R. T., Geleijnse, J. M., & Trautwein,
E. A. (2014). LDL-cholesterol-lowering effect of plant sterols and stanols
across different dose ranges: A meta-analysis of randomized controlled studies.
British Journal of Nutrition, 112(2), 214–219. https://pubmed.ncbi.nlm.nih.gov/24780090/
Ren, W., Wang, W., Zhang, Y., Liu, W., Li, Y.,
Wang, L., … & Zhang, Z. (2023). Mitochondria-targeted ergosterol peroxide
derivatives: Synthesis, anticancer properties and their preliminary mechanism
of inhibiting MCF-7 cell proliferation. Journal of the Brazilian Chemical
Society, 34(10), e2301220. https://doi.org/10.21577/0103-5053.20230058
Song, M., Wu, K., Meyerhardt, J. A., Ogino,
S., Wang, M., Fuchs, C. S., & Giovannucci, E. L. (2018). Fiber intake and
survival after colorectal cancer diagnosis. JAMA Oncology, 4(1), 71–79.
https://doi.org/10.1001/jamaoncol.2017.3684
Toledo, E., Salas-Salvadó, J., Donat-Vargas,
C., Buil-Cosiales, P., Estruch, R., Ros, E., … & Martínez-González, M. A.
(2015). Mediterranean diet and invasive breast cancer risk among women at high
cardiovascular risk in the PREDIMED trial: A randomized clinical trial. JAMA
Internal Medicine, 175(11), 1752–1760.
https://doi.org/10.1001/jamainternmed.2015.4838
Wei, T., Li, R., Guo, S., & Liang, C.
(2024). Stigmasterol exerts antiglioma effects by regulating lipid metabolism.
Molecular medicine reports, 30(6), 227. https://doi.org/10.3892/mmr.2024.13351
World Health Organization. (2022). Cancer fact
sheet. Retrieved from https://www.who.int/news-room/fact-sheets/detail/cancer
Woyengo, T. A., Ramprasath, V. R., &
Jones, P. J. H. (2009). Anticancer effects of phytosterols. European Journal of
Clinical Nutrition, 63(7), 813–820. https://doi.org/10.1038/ejcn.2009.29
Zhao, J. Q., Hao, Y. Y., Gong, T. T., Wei, Y.
F., Zheng, G., Du, Z. D., Zou, B. J., Yan, S., Liu, F. H., Gao, S., Wu, Q. J.,
& Zhao, Y. H. (2022). Phytosterol intake and overall survival in newly
diagnosed ovarian cancer patients: An ambispective cohort study. Frontiers in
Nutrition, 9, 974367. https://doi.org/10.3389/fnut.2022.974367